Problemă:
Un amestec de propan şi butan, ocupând un volum egal cu 10 ml, este supus arderii în exces de oxigen. După condensarea apei, de gazele rămase sunt trecute printr-o soluţie de KOH, volumul acestora reducându-se cu 36 ml. Determinaţi compoziţia în procente de volum a amestecului iniţial de hidrocarburi. (Volumele de gaze sunt măsurate în condiţii normale de temperatură şi presiune.)
Rezolvare
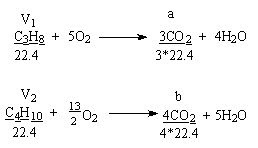
Ecuaţiile reacţiilor chimice:
KOH va reţine din amestecul de gaze rezultat după condensarea apei doar dioxidul de carbon, iar reducerea de volum de 36 ml este chiar volumul de dioxid de carbon rezultat din ardere.
V1 = volumul de propan
V2 = volumul de butan
a = volumul de CO2 rezultat din arderea propanului
b = volumul de CO2 rezultat din arderea butanului
Conform datelor problemei avem: V1 + V2 = 10 ml (1) şi
a+b =36 ml (2)
De pe ecuaţiile reacţiilor se obţine:
V1 = a/3 şi V2 = b/4, adică, înlocuind în relaţia (1) a/3 + b/4 = 10 (3).
Folosindu-ne de relaţia (2) vom obţine a = 12ml şi b = 24ml.
De aici, V1 = 4ml si V2 = 6 ml, iar
%C3H8 = 40%
%C4H10 = 60%
Iosif Schichetanz, Florin Badea - Chimie Organică prin probleme